摘要
小分子与其受体之间的静电相互作用对于分子识别是必不可少的。理想情况下,蛋白-配体的静电势应最大化其互补性,同时最大限度地减少去溶剂化损失。Flare提供了一种快速有效的工具来计算、可视化蛋白-配体的静电互补性(EC)。用几个静电驱动SAR数据集证明了EC方法可以可视化、理性地预测静电驱动的配体亲和力变化和化合物的选择性,静电互补性分析方法为药物设计提供了强大且通用的工具。
用EC研究XIAP配体的SAR
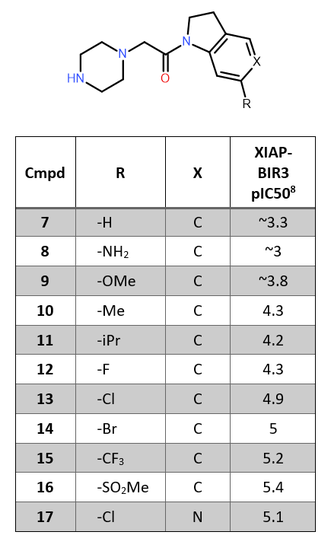
凋亡蛋白抑制剂(IAPs)是抗细胞凋亡和促存活信号通路的关键调节因子。2-4它们的失调发生与各种癌症中,并且与肿瘤生长、治疗抗性和预后不良有关。这使得它们成为抗癌药物发现的有吸引力的靶标。5-7最佳表征的IAP,X连接的IAP(XIAP)通过其BIR结构域结合并失活半胱天冬酶3,7和9(Caspases 3,7,9)来发挥其抗细胞凋亡活性。通过小分子干扰XIAP-BIR结构域和半胱天冬酶之间的蛋白-蛋白相互作用(PPI)是抑制XIAP有前景的策略。然而,由于其不寻常的结合界面,平坦且宽大,与通常经典的结合位点不同使得PPI药物开发特别具有挑战性。8
Astex一篇最新文献报道9,Table 1中拮抗剂数据集的XIAP-BIR3活性通过在二氢吲哚环上引入吸电子取代基而增加,并且显示出XIAP-BIR3 pIC50和Hammett's σp之间的良好相关性。
在本案例研究中,我们使用Flare中的静电互补等值图图来研究蛋白质 - 配体静电相互作用以及Table 1中分子的SAR。用Flare计算的静电互补性评分可用于定量模拟XIAP-BIR3的pIC50。
Table 1. XIAP-BIR3 affinity of C-6 substituted indolines.8
方法
蛋白准备
将PDB Code为5C7A的配体-蛋白质复合物从Protein Data Bank下载到Flare中,并使用来自BioMolTech的Build Model10,11加氢、优化氢键、去除原子碰撞并给蛋白结构分配最佳质子化状态,并对被截短的链末端进封端。检查结合位点,确保配体和氨基酸侧链的具有正确质子化状态,并重新优化水的取向以利于氢键网络的形成。在结合位点中仅保留那些靠近结合位点并与蛋白质具有至少2个氢键接触,或者至少与配体一个氢键接触的水,这些水和蛋白一起进行静电互补计算。由于许多模拟的结合模式(例如化合物9、11、15、16)与Lys297的柔性侧链(Figure 1)发生冲突,所以对侧链原子用XED力场12进行能量最小化,所得受体用于计算与各化合物的静电互补性。
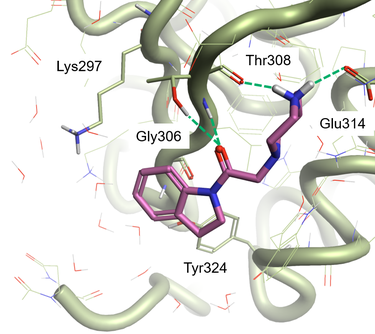
Figure 1. The PDB: 5C7A ligand-protein complex.
数据集构建
Table 1中的化合物以PDB 5C7A中配体(Table 1的化合物7)为模板用Flare中的分子编辑器绘制而得。然后再用Forge13的最大公共子结构叠合方式将11个化合物叠合到5C7A的配体上,以使得公共的二氢吲哚-哌嗪骨架的构象噪音最小。
EC表面与打分
静电互补性(EC)图和打分函数是基于Cresset可极化XED力场的Flare蛋白相互作用势的扩展。与原子中心电荷的经典力场相比,XED能够描述原子周围的各向异性电荷分布,这通常只能通过从头算方法实现。原子电荷各向异性的极化效应和描述对于计算芳香族或不饱和烃,sp2杂化氧原子,sp或sp2杂化氮原子和芳香族卤素(Cl,Br和I的sigma空穴)的静电特性特别有用。14-16
为了计算配体对目标蛋白质的EC图,首先要计算配体的溶剂可及表面。然后在表面上的每个顶点处计算由配体和蛋白质引起的静电势。
然后将这些静电势缩放,加在一起并归一化以产生静电互补性得分。完美的静电互补性意味着在每个顶点处配体静电势值与具有反向符号的相同量级的蛋白静电势值配对。与蛋白质具有静电互补性的配体表面区域为绿色,而存在静电冲突的区域为红色。有关静电势和互补性方法学的更详细描述将在别处进行更详细地描述。17
静电互补性打分量化了配体 - 蛋白之间的静电互补性,三种不同指标的分别适用于不同蛋白质- 配体相互作用场情。
第一个打分值为Complementarity,是配体表面上互补性得分的归一化表面积分,实际上是配体表面上该得分的平均值。
另外两个打分值为Complementarity r 和Complementarity rho分别是Pearson相关系数和Spearman等级相关系数,它们是根据在表面顶点上采样的原始配体和蛋白质静电势计算的。
这三个指标的范围从1(完全互补)到-1(完美冲突),但具有不同的特征。Complementarity打分包含了对去溶剂化效应的一些补偿,因此当这些效果显著时可能更加稳健。Pearson和Spearman相关系数在某些情况下可以提供更好的配体活性指示,但更容易受到噪音的影响(r比rho更容易受影响)。 Spearman的rho值对背景电场更加稳健,如果计算的蛋白静电势被蛋白上的大净电荷偏置,这时它就会很有用。
计算速度快且具有预测性:在普通笔记本电脑上对一百个配体进行打分通常需要不到几分钟的时间,并对蛋白 - 配体静电提供重要的见解,而这通常与化合物活性相关。
XIAP活性位点的静电分析
XIAP活性位点(PDB:5C7A,Figure 2-左)中化合物7的静电互补性图表明:在二氢吲哚环上方区域中存在强的静电冲突(红色)。这是由于蛋白活性位点的负静电势区域引起的,由Gly306的主链羰基和Tyr324的酚氧(Figure 2 - 中)产生,与二氢吲哚环相关的负静电场发生冲突(Figure 2 - 右)。Lys297质子化侧链的正静电场(Figure 2-中)和二氢吲哚环的σ氢的正静电场之间可以看到不太明显的静电冲突(Figure 2-右)。
根据该图(与报道的相关性一致8),预期使吲哚啉环不太富电子的吸电子取代基将增加XIAP结合亲和力。与更负(或更少正)静电场相关的取代基,将有利于与Lys297的质子化侧链的相互作用,也应是有益的。
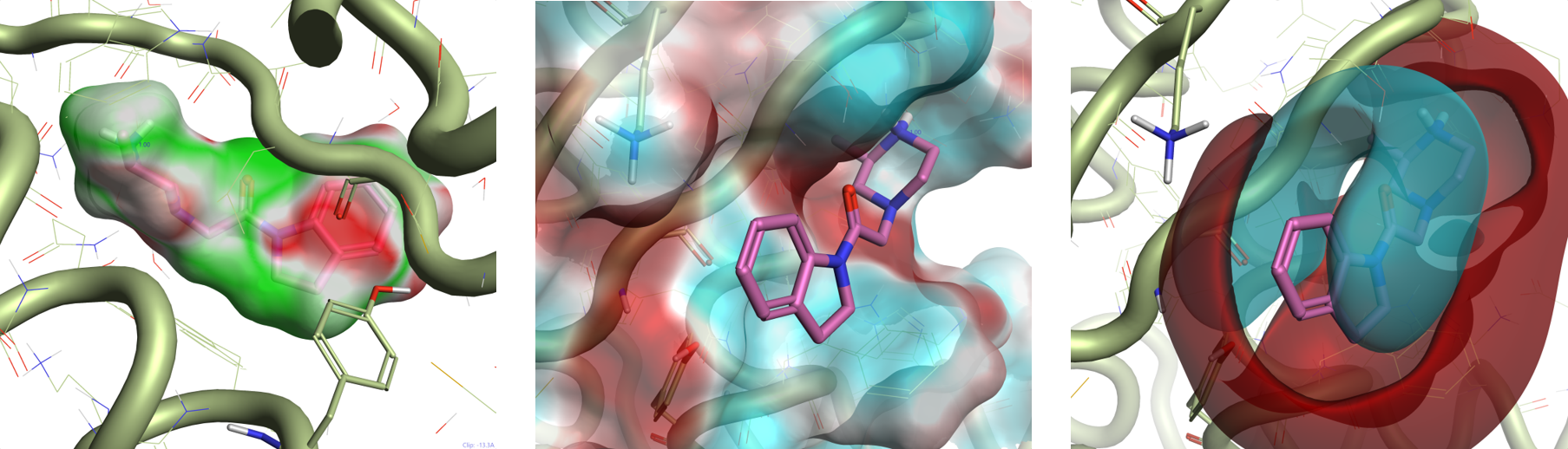
Figure 2. Left: Electrostatic Complementarity map for the PDB:5C7A ligand (green: good complementarity; red: electrostatic clash). Middle: protein electrostatic potential map for PDB:5C7A (red: positive; cyan: negative). Right: ligand fields for the ligand in PDB:5C7A (red: positive; cyan: negative.
EC与XIAP的SAR
图3显示了表1中化合物的静电互补性图,从左到右按XIAP-BIR3活性增加的顺序显示。当我们从给电子取代基(-NH2,-OMe)移动到吸电子取代基-F,-Cl,-SO2Me时,可以观察到明显的趋势。这使得二氢吲哚环的电子密度降低,减少了与XIAP活性位点负静电的冲突。
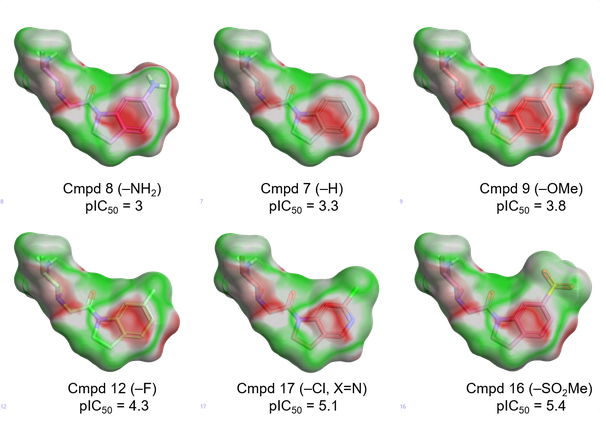
Figure 3.Table 1配体的静电互补性图(绿色:良好的互补性; 红色:静电冲突)
根据我们的初步假设,三种最有效化合物的取代基也与它们自身的负配体场相关(Figure 4),有利于与Lys297的质子化侧链的相互作用。
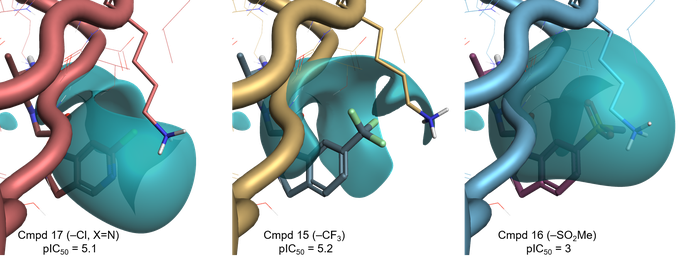
Figure 4. 化合物17、15、16的负配体场(青色)
这些定性观察结果可被XIAP-BIR3 pIC50与Figure 5中显示的Complementarity rho打分之间的良好相关性(r2 = 0.671)证实。
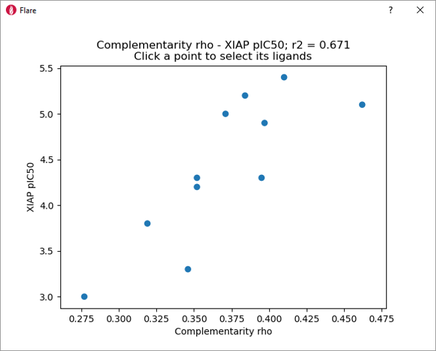
Figure 5. XIAP-BIR3 pIC50 versus Complementarity rho
EC打分与分子量
我们监测了MW与XIAP-BIR3亲和力/Complementarity rho之间的相关性,以验证静电互补性打分是否提供超出使用简单物理化学描述符用于药物设计的信息。
MW和XIAP-BIR3 pIC50(r2 = 0.613,图6-左)之间的相关性可能指向空间填充效应,作为该数据集中XIAP亲和力变化的最简单解释。
然而,Complementarity rho和MW之间的低相关性(Figure 6-右)证实了静电互补性打分与分子的尺寸无关。因此,使用静电互补性打分进行定量SAR建模,可以产生完全独立于尺寸效应的趋势。此外,静电互补图提供了对配体-蛋白结合和SAR的视觉洞察,其不能从传统的、简单的物理化学描述符(例如MW和Hammett的σp)中获得,因此为药物设计提供了宝贵的信息。
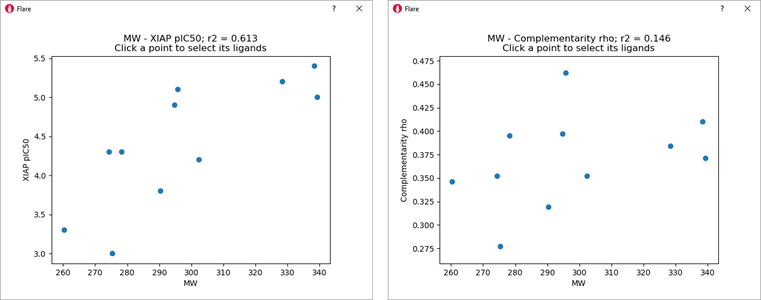
Figure 6. Left: Plot of XIAP-BIR3 pIC50 versus MW. Right: Plot of Complementarity rho versus MW.
总结
将静电互补应用于文献报道的XIAP-BIR3数据集表明,我们的方法可以检测和量化XIAP配体中导致生物活性变化的静电差异。 基于Cresset可极化XED力场的Flare V2静电互补性图和打分,可以对新设计的快速的预测活性并提供视觉反馈。它们为理解配体结合和SAR提供了有用的信息,可用于快速地对新设计的分子进行排序。
文献
1. https://www.cresset-group.com/flare
2. Salvesen, G. S. et al., Rev. Mol. Cell Biol. 2002, 3 (6), 401-10
3. Gyrd-Hansen et al., Nat. Cancer 2010, 10 (8), 561-74
4. Silke, J. et al., Cold Spring Harbor Perspect. Biol. 2013, 5 (2), a008730
5. I et al., Clin. Cancer Res. 2004, 10 (11), 3737-3744
6. Mizutani, Y. et al., Int. J. Oncol. 2007, 30 (4), 919-925
7. Fulda S. et al., Nat. Rev. Drug Discovery 2012, 11 (2), 109 -124
8. Arkin, M. R. et al., Chem. Biol. 2014, 21 (9), 1102-1114
9. Chessari, G. et al., J. Med. 2015, 58 (16), 6574-6588
10. V. Stroganov et al., Proteins 2011, 79 (9), 2693-2710
11. https://www.biomoltech.com/
12. https://www.cresset-group.com/science/field-technology/calculating-field-patterns/
13. https://www.cresset-group.com/products/forge/
14. Vinter, J. G., Comput. Aided Mol. Des. 1994, 8 (6), 653–668
15. Vinter, J. G., Comput. Aided Mol. Des. 1996, 10 (5), 417–426
16. Chessari, G. et al., Chem. Eur. J. 2002, 8 (13), 2860–2867
17. Bauer, M. R.; Mackey, M. D. Electrostatic Complementarity as a Fast and Effective Tool to Optimize Binding and Selectivity of Protein-Ligand Complexes. J. Med. Chem. 2019, acs.jmedchem.8b01925. https://doi.org/10.1021/acs.jmedchem.8b01925