Sylvie Sciammetta†
† Cresset, New Cambridge House, Bassingbourn Road, Litlington, Cambridgeshire, SG8 0SS, UK
概要
化学空間探索からリード最適化にいたるまで、創薬研究の多くの場面で構造活性相関 (SAR) をよく理解することは必要不可欠です。この事例紹介では、近くFlare™に統合されるForge™の主要な2つの機能であるActivity Miner™とActivity Atlas™を活用し、一連のベンゾオキサゼピノンRIPK1阻害薬の多角的なSAR分析を行います。
またこのSAR分析に、Flareのタンパク質相互作用ポテンシャル (PIP) およびElectrostatic Complementarity™ (EC) 静電的相補性マップを組み合わせることにより、リガンド設計においていかに有益な情報が得られるかを示します。
はじめに
受容体相互作用タンパク質キナーゼ1 (RIPK1) は、様々な炎症と関わり細胞の生死を決定づける働きをもつことが知られており、自己免疫疾患、炎症性疾患ならびに発癌性疾患の治療のための有望な治療標的として注目されています。その独特の構造により、これまでにも高選択的な低分子阻害薬が開発されてきました。すでにいくつかの候補薬は、乾癬・関節リウマチ・潰瘍性大腸炎などの炎症性疾患の治療、ALSやアルツハイマー病などのCNS適応症や、膵臓がんの治療薬として臨床研究が活発に行われています。
RIPK1阻害薬として、GlaxoSmithKline (GSK) のDNAエンコードライブラリーを用いたスクリーニングから、RIPK1高選択的なベンゾオキサゼピノン類が発見されました。その事例を取り上げ、改めてFlareのActivity AtlasとActivity Minerを活用して、ベンゾオキサゼピノンGSK’481ヒット (図1A) 周辺の構造・活性の相関を調べてみます。
RIPK1阻害薬データセットの準備と重ね合わせ
ここで用いる全46個の化合物群からなるデータセットは、BindingDBと論文のサポート情報 (Philip A. Harris et al. at GSK) から得られます。文献情報からそれらのpIC50は4.9~10.3の範囲に広く分布しSAR解析には好都合です。また一方で、RIPK1に結合したGSK’481の複合体結晶構造 (PDB: 5HX6) についてはProtein Data Bankから入手可能で、その構造を改めてFlareで丁寧に最適化しました。
データセットの各分子の互変異性とプロトン化状態を適切に調整します。また、各分子の配座をConformation Huntの「Very accurate but slow」条件下で発生し、「Permissive」(複素環の反転を容認する)モードとタンパク質排除体積を「Hard」に設定して、公開されているGSK'481 (PDB: 5HX6) のX線結晶構造の上に最大共通構造に基づいて重ね合わせました。
3D類似性を精度よく評価するためには、化合物の慎重な重ね合わせが必要となります。重ね合わせが不十分だと構造活性相関解析に不都合なノイズとなってしまいます。従って、重ね合わせは自動処理に頼り過ぎず必ず目視で確認し、必要に応じて手作業で修正することが推奨されます。このデータセットにおいても、化合物1のチアゾール環およびベンジル環を手作業で反転/回転させ、重ね合わせを微修正しています。こうすることにより、データセット全体にわたって一貫した配向をもつベンジル環の整列が得られます (図1B)。
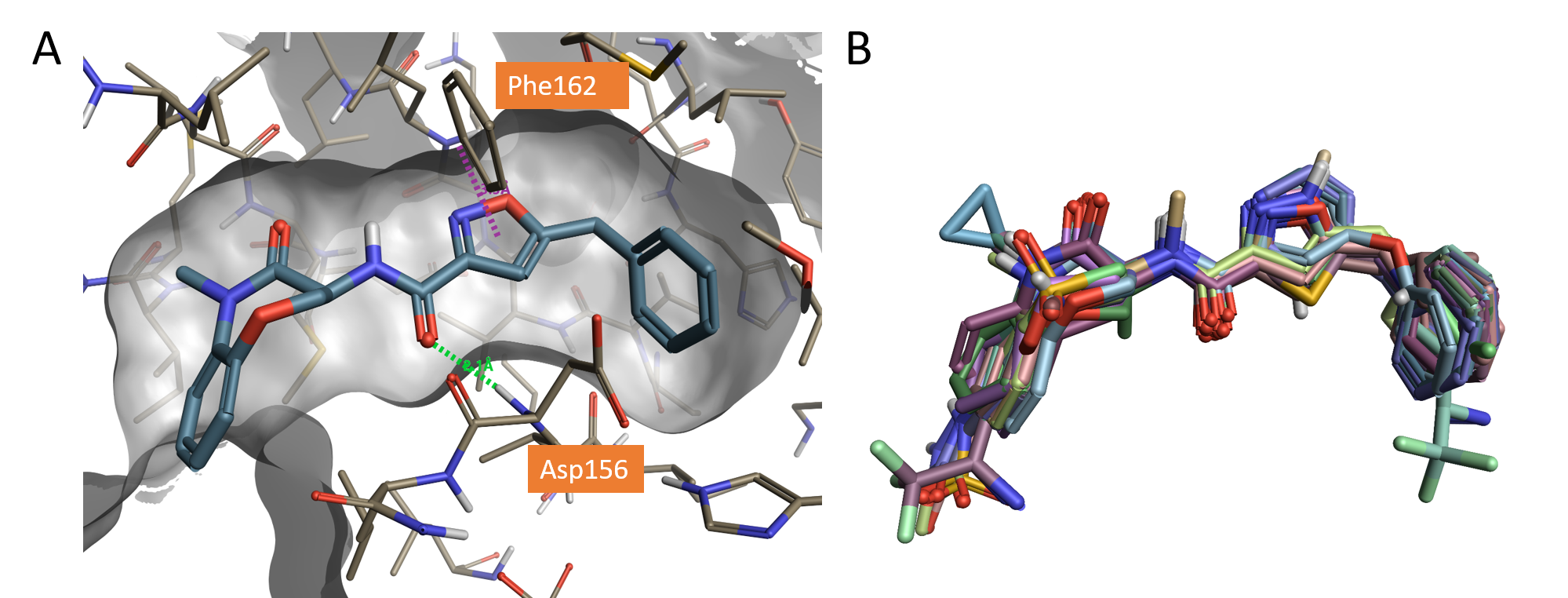
図1. A. RIPK1活性部位 (PDB: 5HX6) に結合したGSK’481 (pIC50 8.8) の結晶構造,水素結合 (緑破線),π-π相互作用 (紫破線).B. FlareによりX線構造に整列された分子セット.
Activity Atlasを用いた構造活性相関分析
Activity Atlasは、一連の整列された化合物の構造活性相関を、静電場、疎水性、および形状の機能性を確率論的に分析する手法です。Activity Atlasは重ね合わせの確からしさをベイジアンモデルで取り扱い、構造-活性要素の大きなデータテーブルから効果的に情報を抽出し、分子群の全体的な定性的特徴を把握するための視覚的な3Dのモデルを作り出し、分子設計・最適化に必要となる有益な情報を与えてくれます。
Activity Atlasの描く「Activity cliff」(活性の絶壁) 概略図は、でこぼこした不連続なSAR空間を可視化します。ここでは、「標準」のモデル構築条件で生成した図を分析し、RIPK1データセットの構造活性相関の支配的な特徴を把握していきます。
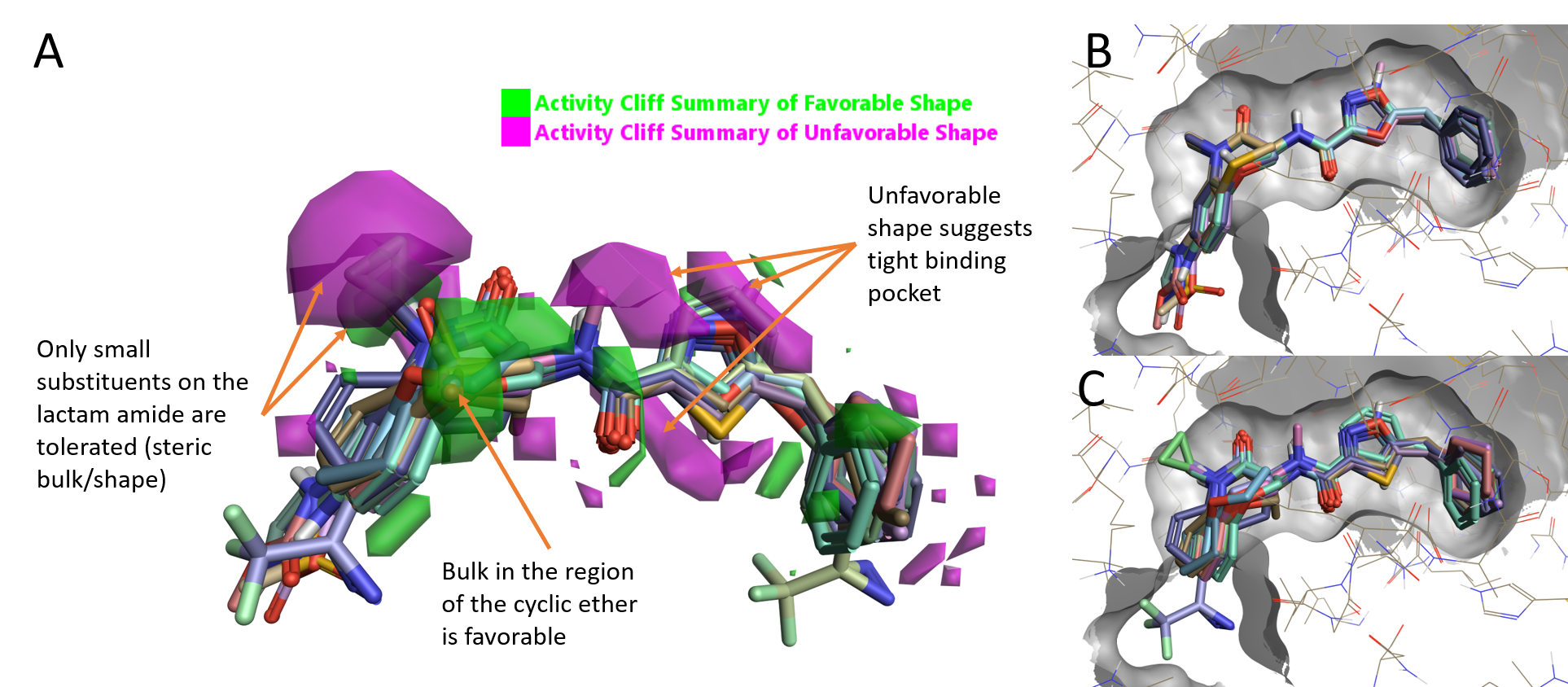
図2. A. RIPK1 Activity Cliff概略図.B. 高活性化合物 (pIC50 10.3-9),C. 低活性 (pIC50 6.7-4.9).
タンパク質の空間的制約の中で整列されたリガンド群を見ると、タンパク質内にはベンゾオキサゼピノン部位のコンフォメーション変化または置換構造に対応する空間的余裕がほとんどないように見えます。実際、高活性分子群 (pIC50 9~10.3) は非常に緊密に整列されています。GSK'481のベンゾオキサゼピノン酸素は硫黄またはNHで置換することのみが許容され、アリールベンゾオキサゼピノン環上は7-位の置換のみ許されます (図2B)。一方、低活性分子群 (pIC50 4.9~6.7) の整列の様からは、タンパク質との立体衝突が想像されます。
図3にベンゾオキサゼピノン部分のラクタムアミドのN-置換の効果を示します。先のActivity Atlasの結果とよく符号し、化合物2 (pIC50 7.49) のNH部分をNMe (GSK'481、pIC50 8.8) に置き換えると活性が向上しますが、N-Et (化合物3、pIC50 5.5) やN-cPr (化合物4、pIC50 5) のより大きな置換基はタンパク質との衝突をもたらし活性発現に不利となります。
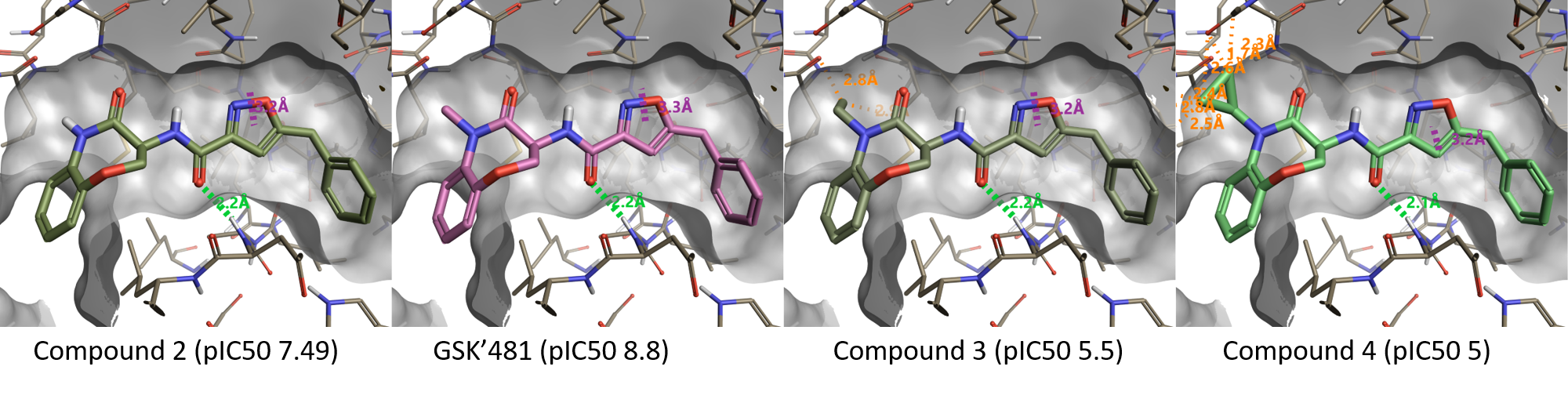
図3. ラクタムアミドのメチルより大きい置換基は不利.
このリガンドシリーズの親水/疎水性のactivity cliffを見ると、疎水性が活性に有利な2つの緑色の領域 (図4A) と、疎水性が活性を低下させる左側のマゼンタ領域があることがわかります。さらに、GSK’481のイソオキサゾール環周囲に好ましくない疎水性領域が広範囲に存在することから、この部分の疎水性は活性に悪影響を及ぼすことが示唆されます。
また、Activity Atlasの結果と一致して、イソオキサゾールCHとラクタムアミドNMeともにRIPK1タンパク疎水性表面の親水性領域 (青) に向かっていることもわかります (図4B)。
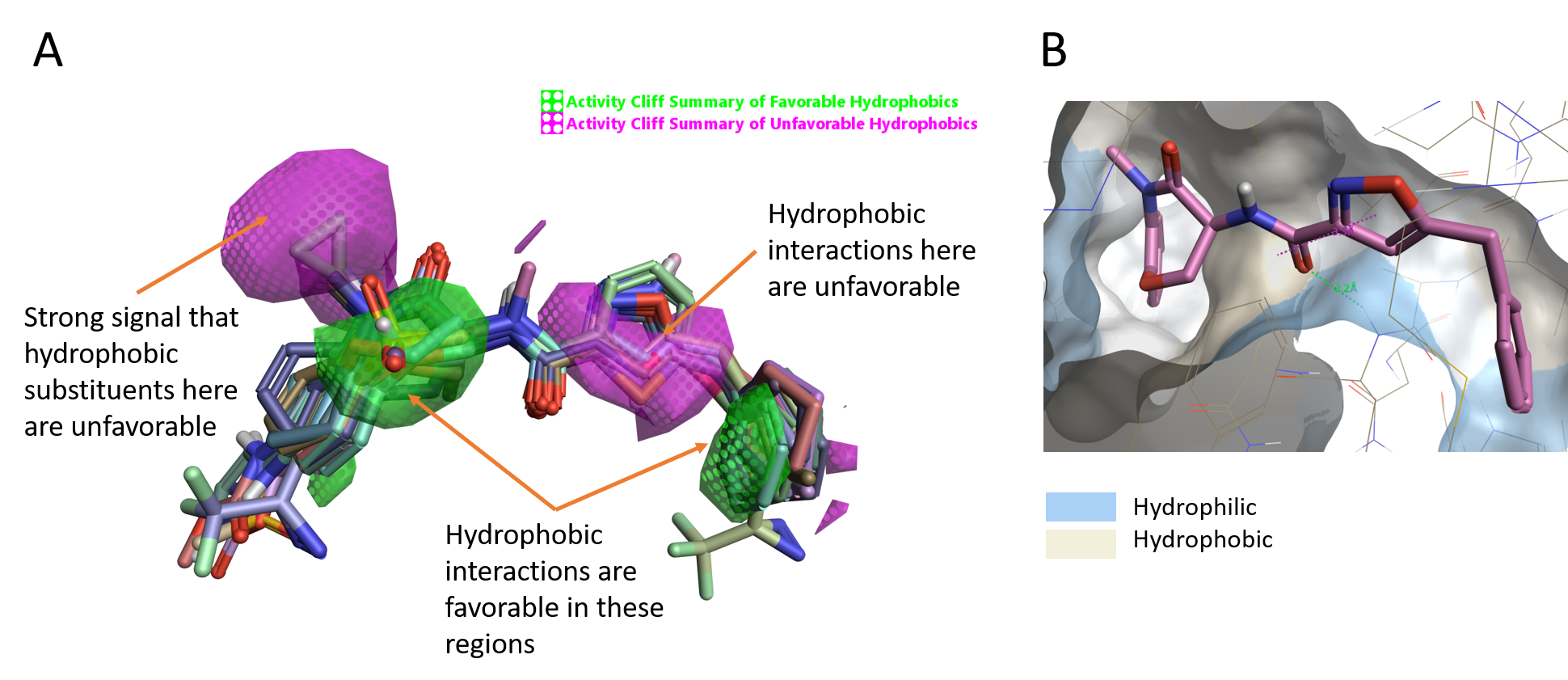
図4. A. 疎水性のactivity cliff.B. RIPK1表面の疎水性/親水性.
静電的activity cliff
「静電的activity cliff」(図5) は、負の静電場 (青) と正の静電場 (赤) がRIPK1の活性に不可欠である領域を明確に示しています。
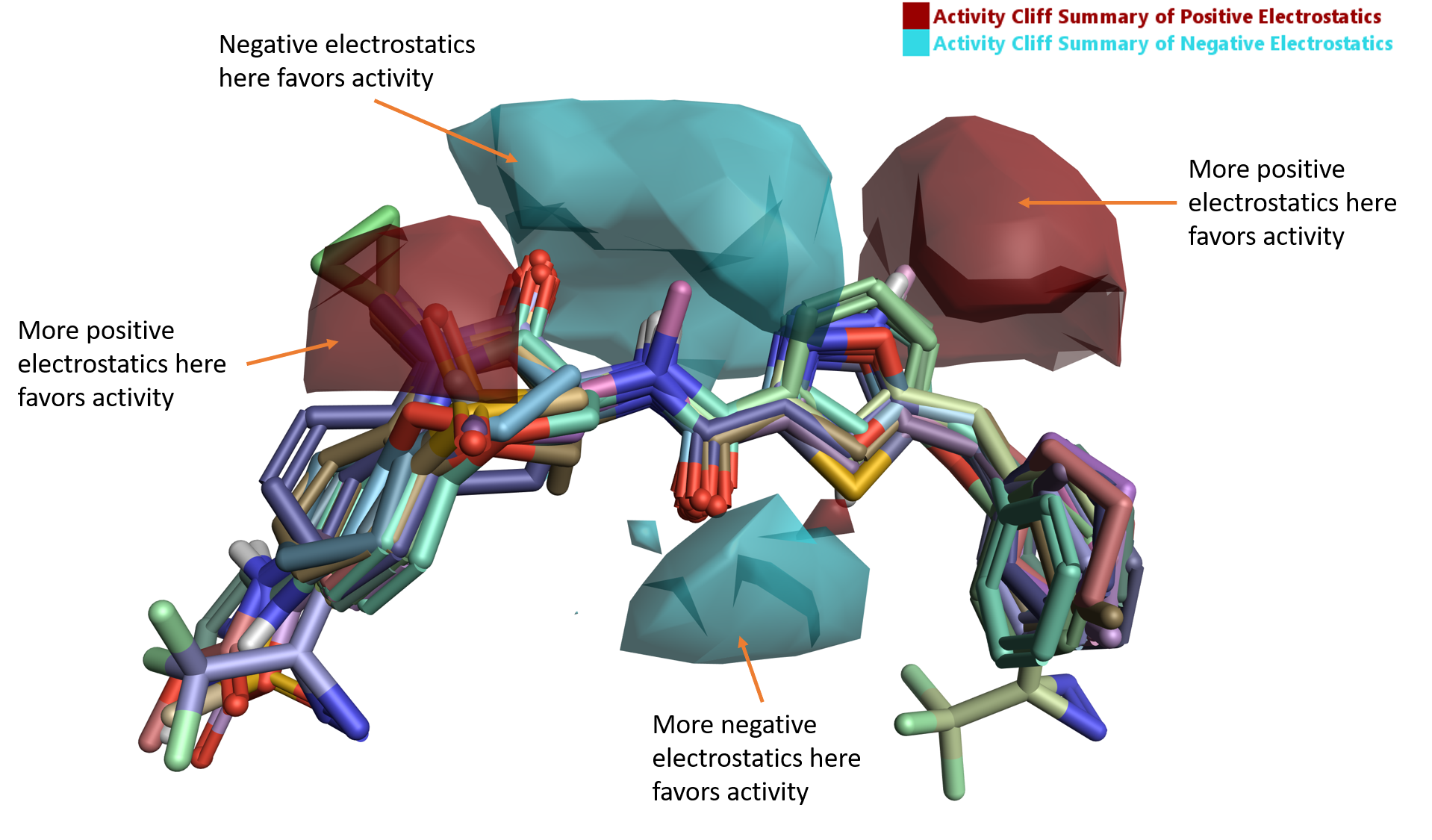
図5. RIPK1の静電的activity cliff.
整列されたリガンド群下部にある負を好む静電場領域は、アミドリンカー上の水素結合を形成するカルボニルの近傍にあり、実際PDB: 5HX6でAsp156のバックボーンNHとの水素結合に対応しています (図1A)。
図5のリガンド群のリンカー領域上部にある大きな正負静電場領域は、ラクタムアミドカルボニルおよび5員環複素環の周囲にあります。典型的なリガンド-タンパク質相互作用だけではRIPK1活性を明確に説明できなくても、Activity AtlasのRIPK1の活性部位のタンパク質相互作用ポテンシャル (PIP) による静電場の分析結果はその静電的傾向を明確にします。
PIPはタンパク質活性サイトの静電場を詳細に描出し、リガンドの結合様式の把握、SARの解釈および標的タンパク質に対する新しい分子設計のためにとても有用です。PDB: 5HX6の活性部位のPIPとオキサゾール5のリガンド場 (pIC50 10.3、シリーズで最も活性の高い化合物) を重ねて比較すると、オキサゾール右側の正電場がRIPK1活性サイトの負電場に合致します。同時に、リガンドの負電場は、RIPK1活性サイトの正電場の領域の中央に位置します (図6A-B)。オキサゾール5のタンパク質に対する静電的相補性をその分子表面上にマッピングすると、分子のタンパク質との関係性も明瞭化されます (図6C)。
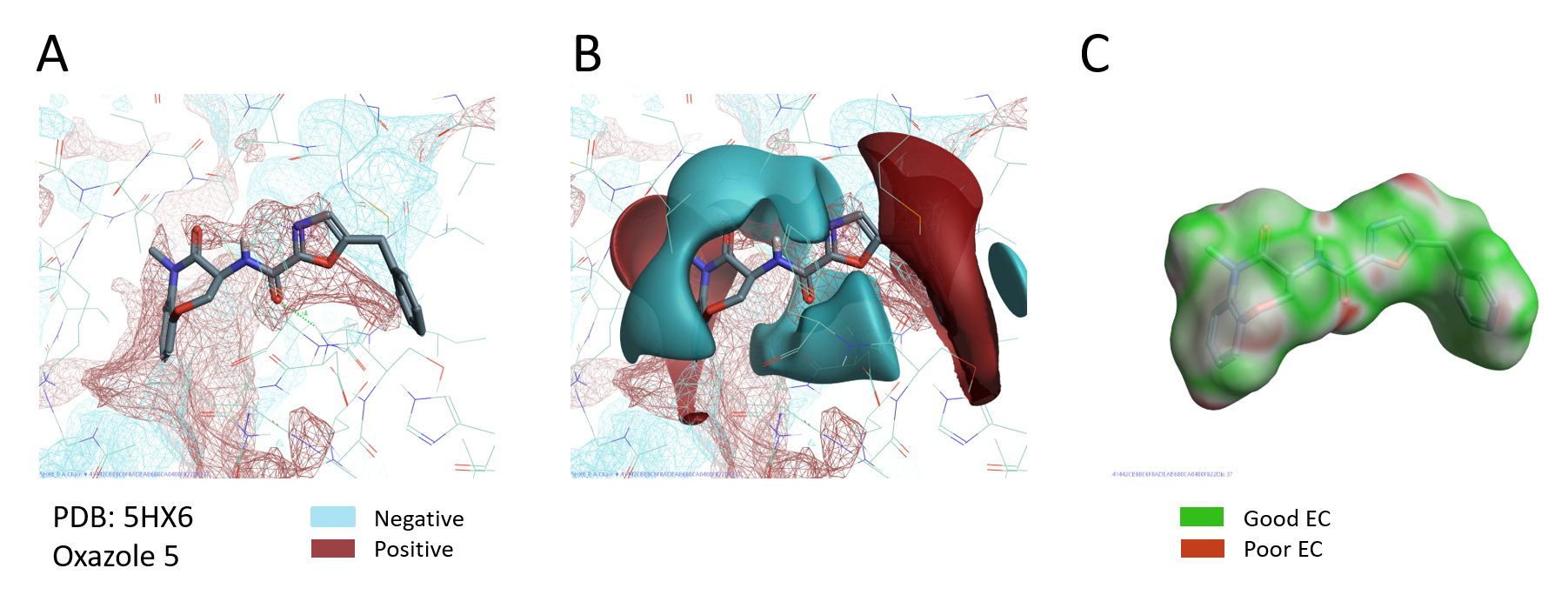
図6. A. RIPK1のPIP (PDB: 5HX6).B. RIPK1のPIPおよびオキサゾール5のリガンド静電場. C. RIPK1に対するオキサゾール5の静電的相補性.
次に、リガンドの静電場の変化がいかにRIPK1活性に影響を及ぼすかをActivity Minerで調べます。これはActivity Atlasを分子ペア単位に掘り下げ、2分子間の構造変化が活性に及ぼす影響を理解し、大きく有利不利となる個別の変換を見つけ出す手助けとなります。
Activity Minerによる詳細な構造活性相関分析
Activity Minerは、構造と活性の全体的な複雑な相関性の中で、分子ペア単位で詳細に調べることを目的とします。活性値の変化を伴う注目する2分子のペアについて、その構造の違いをハイライトします。ナビゲーションを可能とするインタラクティブなユーザーインターフェースを通して、分子設計のための多くのインスピレーションが得られるでしょう。Activity Minerは「不同性」(disparity、訳注) またはactivity cliffの概念を発展させ、構造の小さな変化が活性に大きな変化を与える不連続なSARのランドスケープを可視化します。
訳注: 分子間のdisparity を(活性値の差)/(1-similarity)で定義し、類似する2分子が大きく活性値を異にする度合いを数量化します。
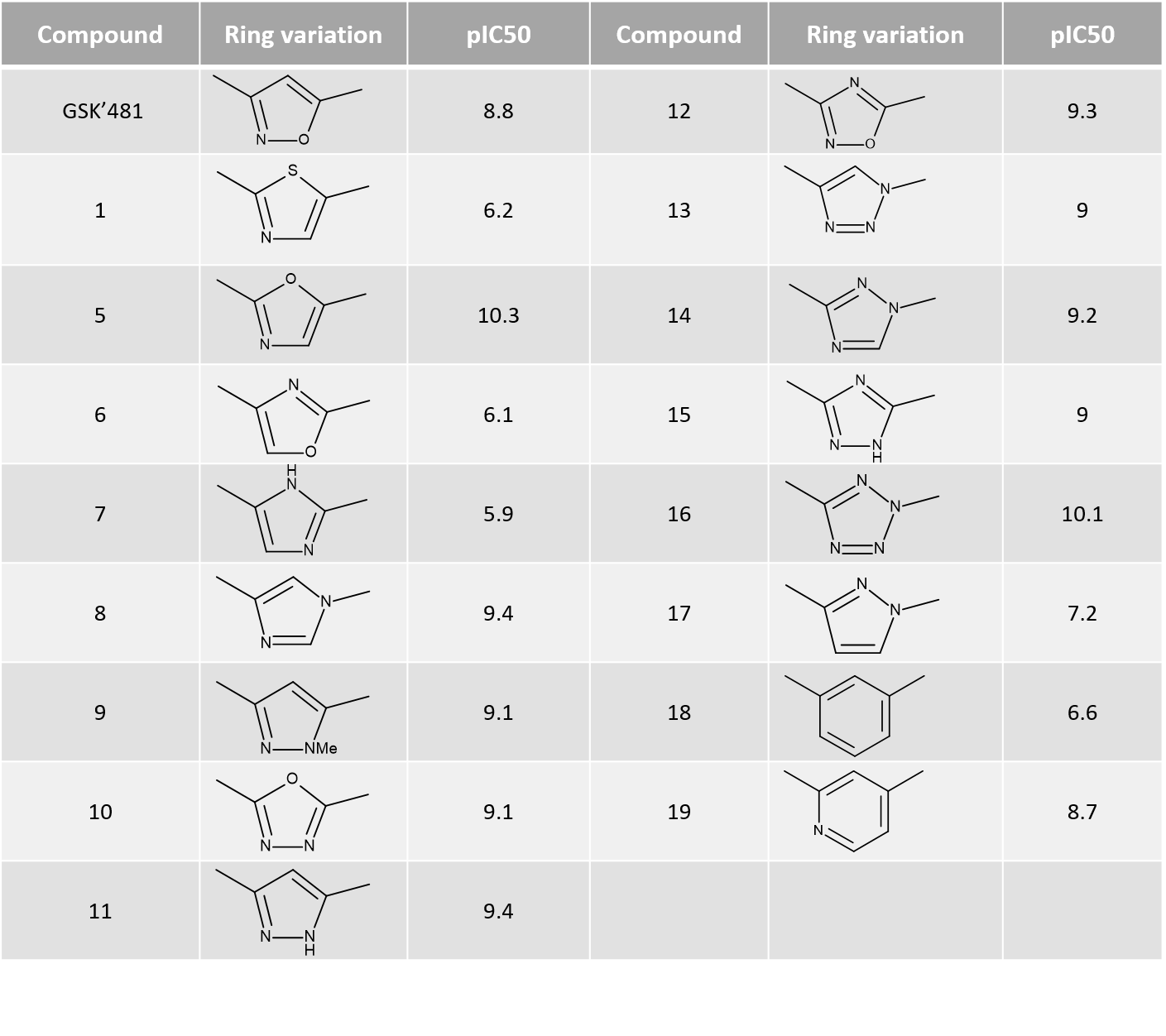
Activity Minerによるリガンド場の違いとPIPを組み合わせ、SARに関わる重要な領域を調べていきます。ここでは、GSK’481のイソオキサゾール環を他の複素環に交換した17分子のサブセットを取り扱います (表1)。
表1. 環の置換とRIPK1 pIC50.
Activity Minerの「Top Pairs」では、選択された活性値に基づくdisparityが大きい分子ペアの一覧が表示され、RIPK1阻害活性pIC50に大きな影響を与える分子の構造変化を網羅的に見つけることができます。上位ペア (図7および8) のリガンドの静電場の違いを見ると、多くの場合、左側 (主に含窒素芳香環) がより負で、右側がより正であれば高い高活性となり、Activity Atlasの結果とRIPK1のPIPの分析結果とも一致します。
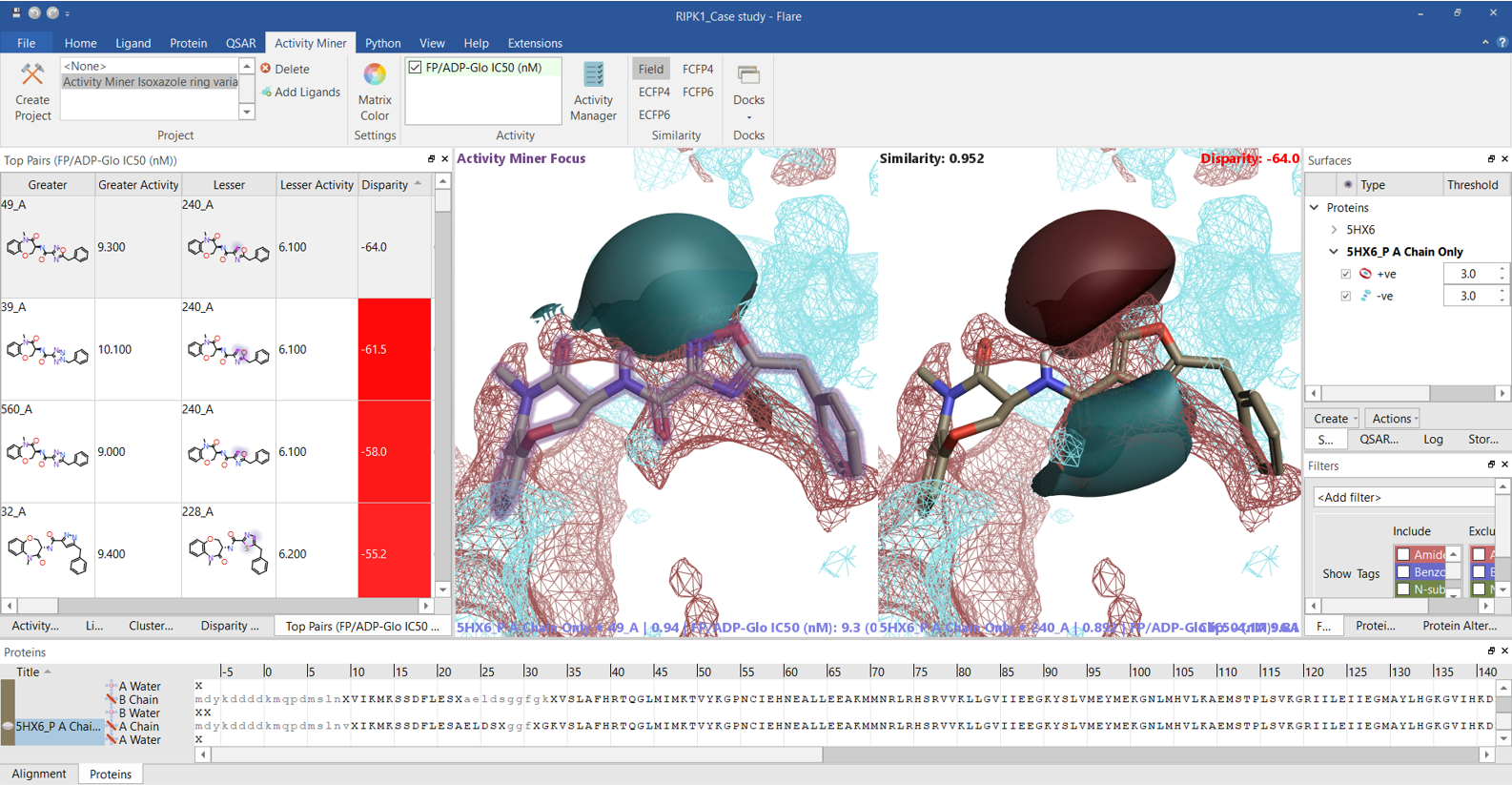
図7. Active Minerの「Top Pairs」: disparityの大きい分子ペア一覧.一方の分子の静電場が他方の静電場に較べてより正ならば赤、より負ならば青.活性の高い化合物が左、低い化合物が右. RIPK1のPIP、赤=正、青=負.
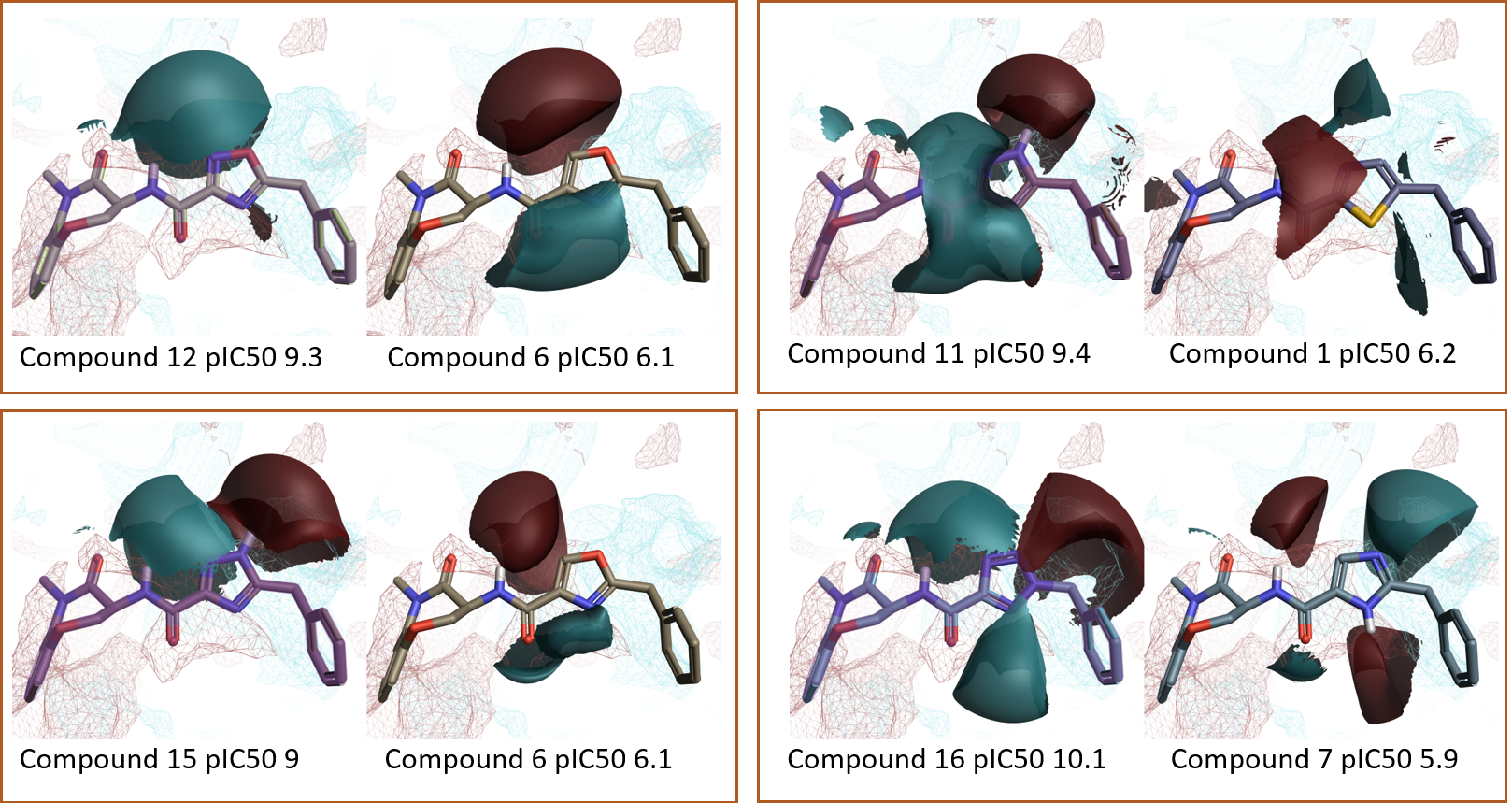
図8. Activity Minerの「Top Pairs」の抜粋.RIPK1活性部位PIPとリガンドの静電場.赤=正電場、青=負電場.
Activity Minerを用いてSARをより詳細に調べると、全般的な傾向からの外れ値が浮き彫りにされます。チアゾール1 (pIC50 6.2) はオキサゾール5 (pIC50 10.3) とたいへんよく似た静電場をもちますが活性がはるかに低くなります (図9A)。これは、硫黄原子のサイズが大きいためチアゾール/ベンジル基の配向が変化し結合ポケットに適合しなくなったと解釈されます。チアゾール環は親油性が高いにも関わらず、タンパク質の親水性領域の近くに来ることで、化合物1の活性の低下の原因となると考えられます (図9B-C)。
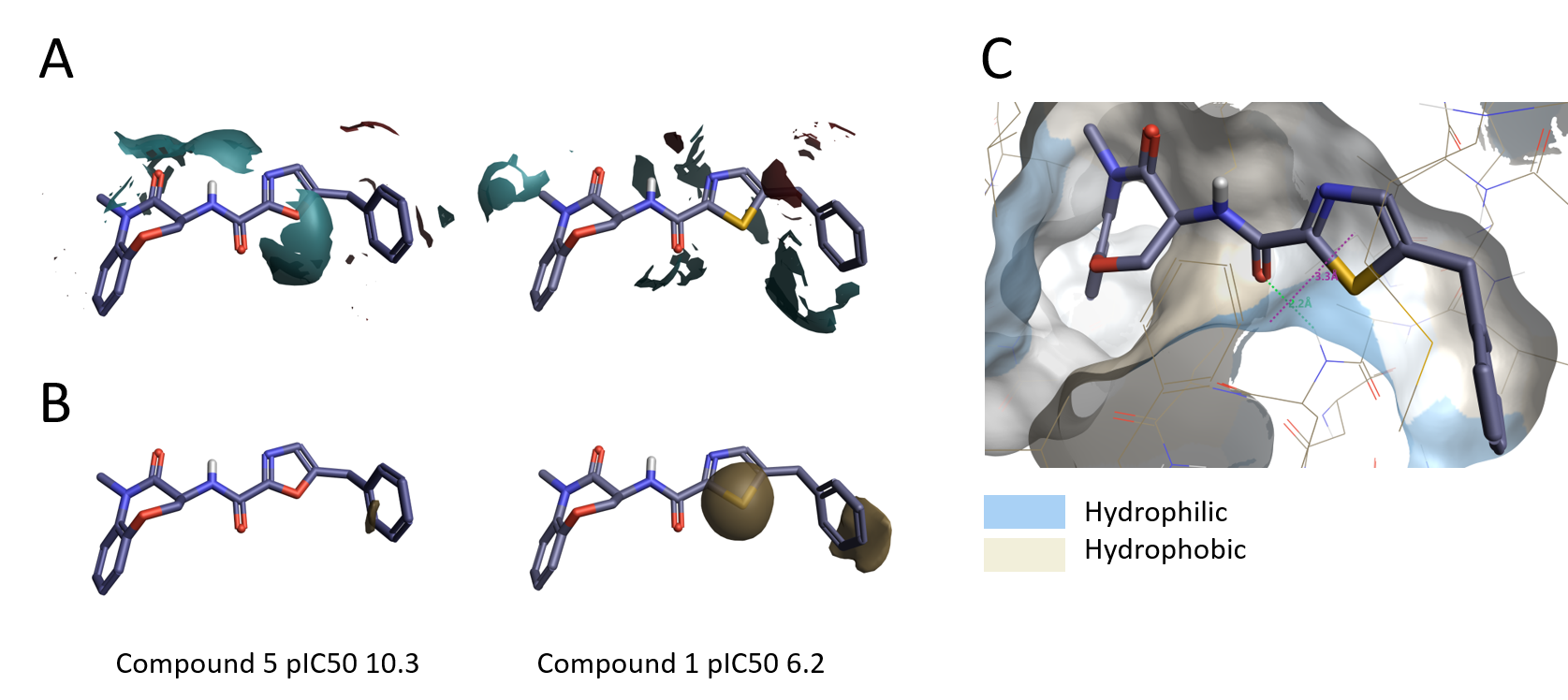
図9. A. オキサゾール5とチアゾール1の静電場の相違.B. 同疎水場の相違.C. RIPK1の活性部位にあるチアゾール1とタンパク質表面の親水性/疎水性.
静電的相補性による構造活性相関分析
タンパク質に対するリガンドの静電的相補性 (EC) は、リガンドの溶媒排除表面におけるリガンドとタンパク質の静電ポテンシャルを比較することによって計算されます。 タンパク質とよい静電的相補性がある表面は緑色で表示され、静電的衝突は赤色で表示されます。
ECスコアは、多様なタンパク質-リガンドシナリオに適した3つの異なるメトリックを使用して、リガンド-タンパク質の静電的相補性を定量化します。
図10は表1のいくつかの化合物のECをRIPK1活性の降順で示しています。
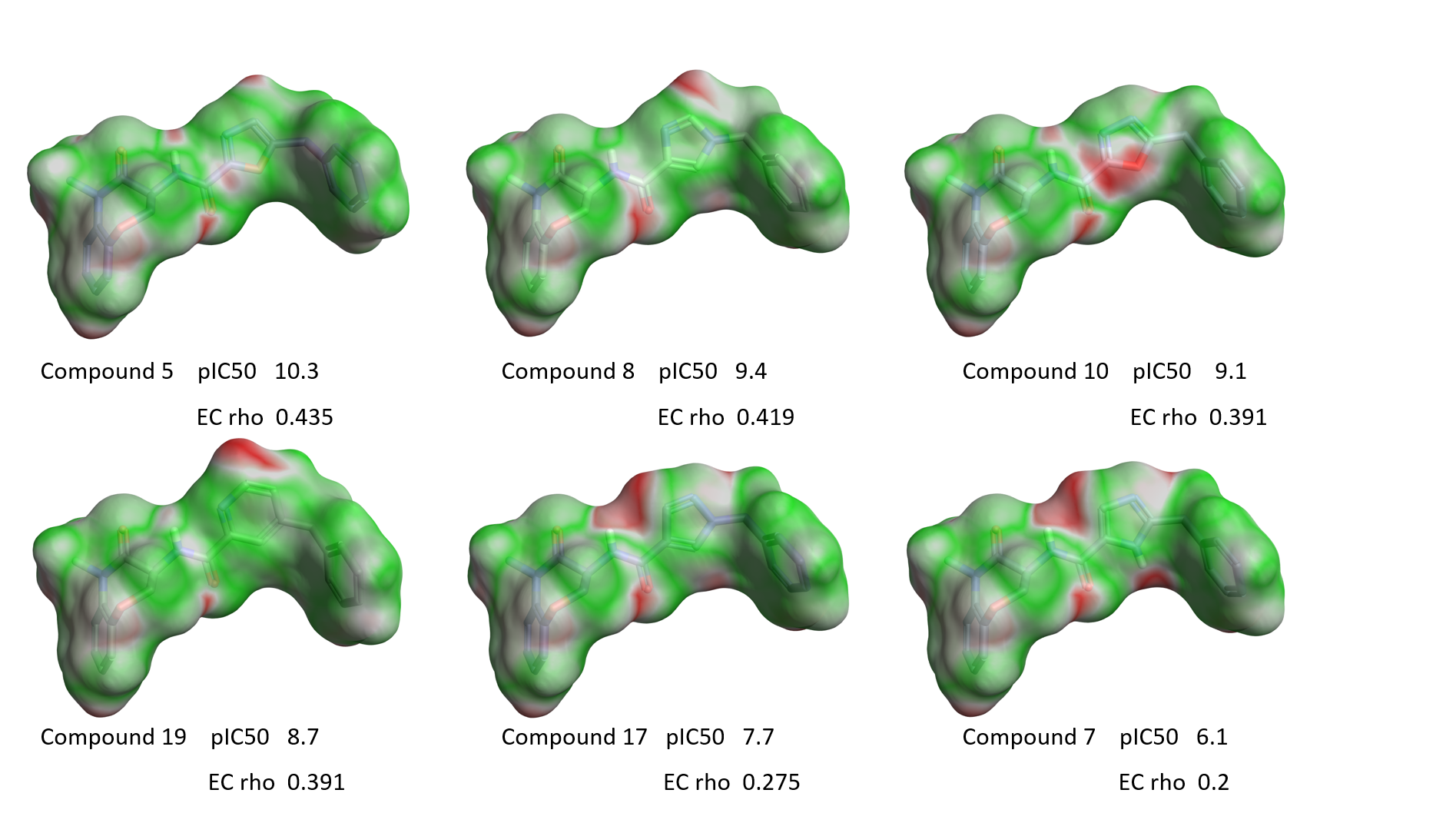
図10. イソオキサゾール環周囲の変化とEC.緑: 高い静電相補性. 赤: 静電的衝突.
図10を見ると、リガンドの活性に伴って静電的衝突の赤い領域が大きく現れるという明確な定性的傾向が見えてきます。この傾向は、図11. Aに示すRIPK1 pIC50対「相補性rho」スコアのプロットによっても確認でき、そこでは2つの明確な外れ値も見つかります。その一つはチアゾール1であり、前述のように硫黄原子のサイズと親水性のために結合モードがやや異なる可能性があります。 また、オキサゾール6の整列された配座 (図11B) においては分子内での水素原子の衝突と孤立電子対の反発があります。これらの分子は、RIPK1結合する際には、重ね合わせで示された配座とは異なる配座を取ることが考えられます。
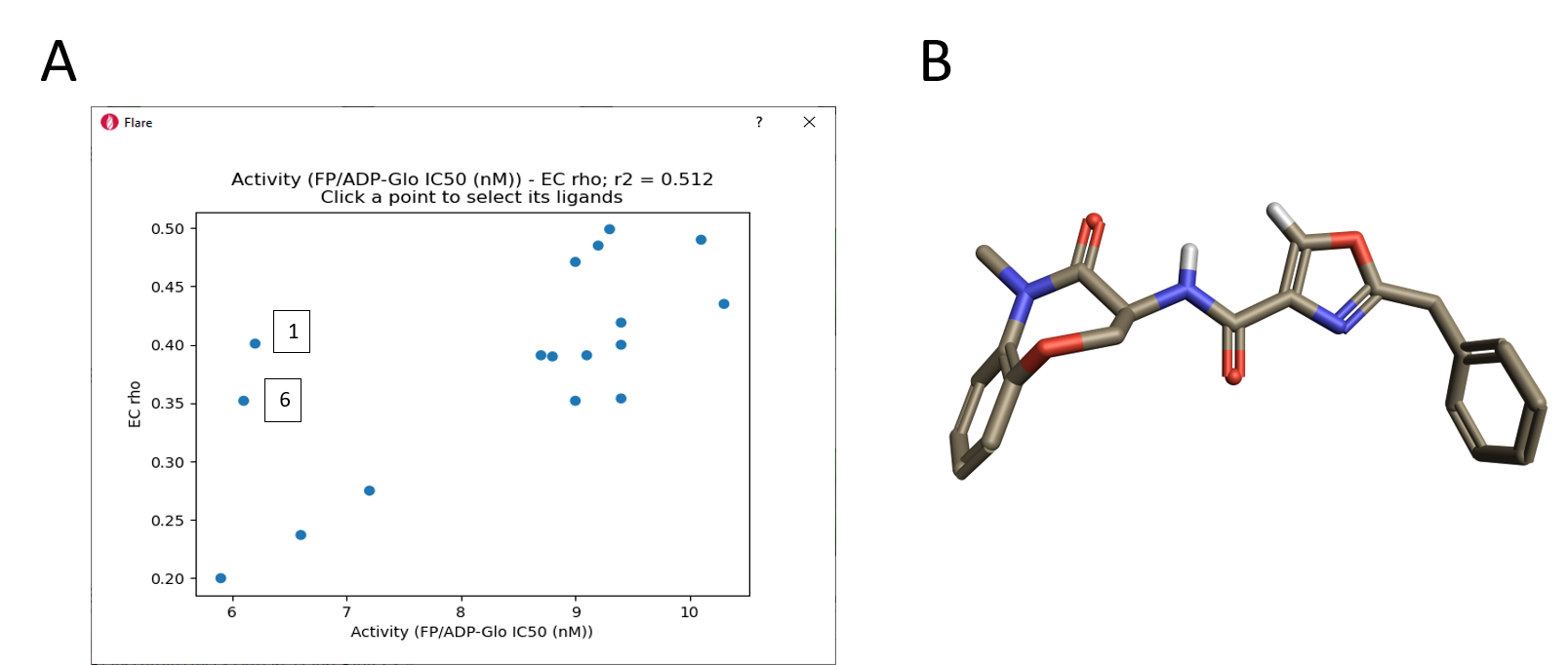
図11. A. ECスコアと活性値の相関.B. オキサゾール6の整列された配座.
結び
2021年夏リリース予定のFlareはこれまでのForgeの機能を完全に統合します。これによって、これまで個別に対応してきた様々なLBDDとSBDDの手法を同一プラットホームで同時に利用することができるようになり、構造活性相関分析、リガンド設計、および創薬化学のより効率的な新しいアプローチを可能とすると期待されます。